
一、实验原理
细胞划痕法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其他硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间,取出细胞培养板,观察周边细胞是否生长至中央划痕区,以此判断细胞的生长迁移能力,实验通常需设定正常对照组和实验组,实验组是加了某种处理因素或药物、外源性基因等的组别,通过不同分组之间的细胞对于划痕区的修复能力,可以判断各组细胞的迁移与修复能力。
二、应用简介
细胞迁移:也成为细胞移动、细胞爬行或细胞运动,是细胞在接受迁移信号或感受到某些物质的梯度后而产生的移动。
细胞迁移参与到很多生理和病理的活动中,如下:
1. 免疫:如淋巴细胞的定向迁移是其分化成熟和发挥功能的关键之一;
2. 炎症:炎症反映最重要的功能是将白细胞送到炎症灶,白细胞迁移到炎症部位并发挥其吞噬和组织损伤作用;
3. 肿瘤转移:迁移是肿瘤细胞转移过程中必不可少的环节之一。肿瘤细胞与母体瘤分离,穿越血管壁,侵袭周边正常组织时,需要一定的运动能力。高转移的肿瘤细胞通常具奋较强的运动性。多种物质可剌激肿瘤细胞的迁移,如肿瘤细胞分泌因子、生长因子、细胞外基质成分(FN、LN)以及一些癌转移靶器官的代谢产物或分泌产物等生长因子对肿瘤细胞有趋化作用,可使其发生定向运动。测定方法以细胞划痕法和Transwell小室法;
4. 损伤修复:当机体发生损伤时,免疫细胞和血小板会迁移到损伤部位,参与消炎和凝血;
5. 胚胎发育:胚胎期不同类型祖细胞迁移至特意靶位以保证各组织、器官的正常发育。
三、实验方法
Culture Insert方法
1.准备细胞,培养液,culture Insert。
2.如图,将细胞接种于Dish中间的Insert,细胞长满Insert区域后用镊子移除Insert即可产生500μm宽度的划痕。
3.每隔4-6小时拍照记录。
4.根据收集图片数据分析实验结果。
传统实验方法
1.培养板划线
首先使用marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。划线时注意线不要太粗 。
2.铺细胞
在孔中加入约5×105个细胞(不同的细胞数量有所不同,根据细胞的生长快慢调整),接种原则为过夜后融合率达到100%。
3.细胞划线
第二天用枪头或者无菌牙签,垂直与细胞平面,沿着投一天划在平板背面的线在细胞层上进行划痕(不同孔之间最好使用同一只枪头或牙签)。
4.洗细胞
划痕完成后,使用无菌PBS洗细胞3次,洗去不贴壁的细胞,即划线时划线的细胞,是划线后留下的间隙清晰可见,然后更换新鲜无血清培养基。
5.细胞培养、观察
将细胞放入37℃ 5% CO2培养箱,培养。然后在适当的时间点,如0,6,12,24h取出细胞,显微镜线观察并测量划痕的宽度,并拍照(具体时间依实验需要而定)。
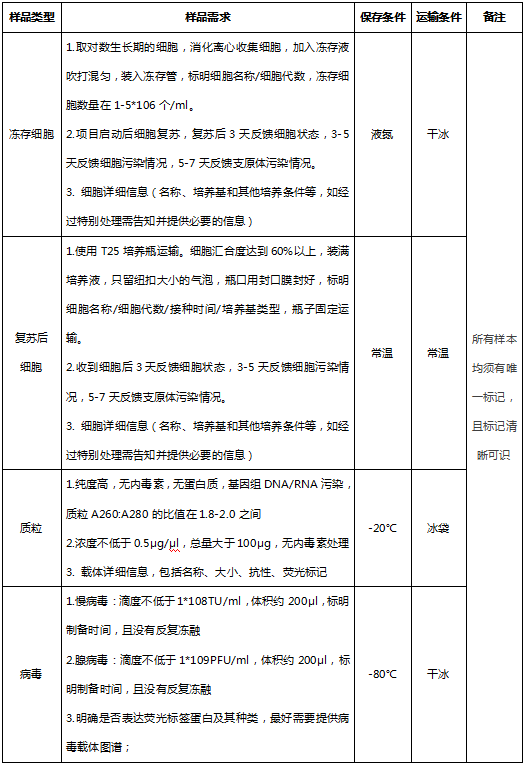
四、样本送检要求
五、案例展示
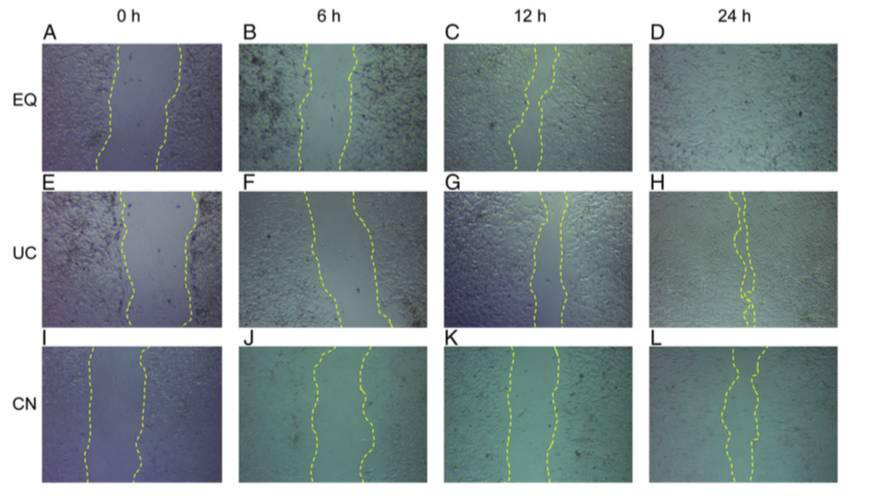
六、常见问题
1.铺细胞最好使用6孔板,因为6空板可以保证有相当距离的平直划痕,而且因为有5条定位线,与划痕相交,这样就有10个可固定监测点,不作重复,误差也很小。当然若是需要高通量初筛时,也可以用12或24孔板。
2.如果你连续监测24小时,你需要考虑到划痕缩小是细胞迁移和细胞繁殖共同作用的结果,而不是单纯的细胞迁移。如果你要单纯的考虑细胞迁移,你可以先用丝裂霉素(1 μg/ml)处理一小时,抑制细胞的分裂,这样你的结果就是细胞迁移的作用了。另外,使用无血清培养基也可以降低增殖对实验结果的影响。
3.照片拍完之后,可以用image J来测量划痕区域的像素定量比较细胞迁移的速度。
4.虽然无血清培养可以忽略细胞增殖的影响,但是由于细胞内信号传导系统整体性的下调节,细胞迁移的速度也会慢很多。
5.在用PBS缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞。
6.为了避免细胞数量和状态受到影响,尽量不要用吸泵,可用移液枪缓慢吸走。
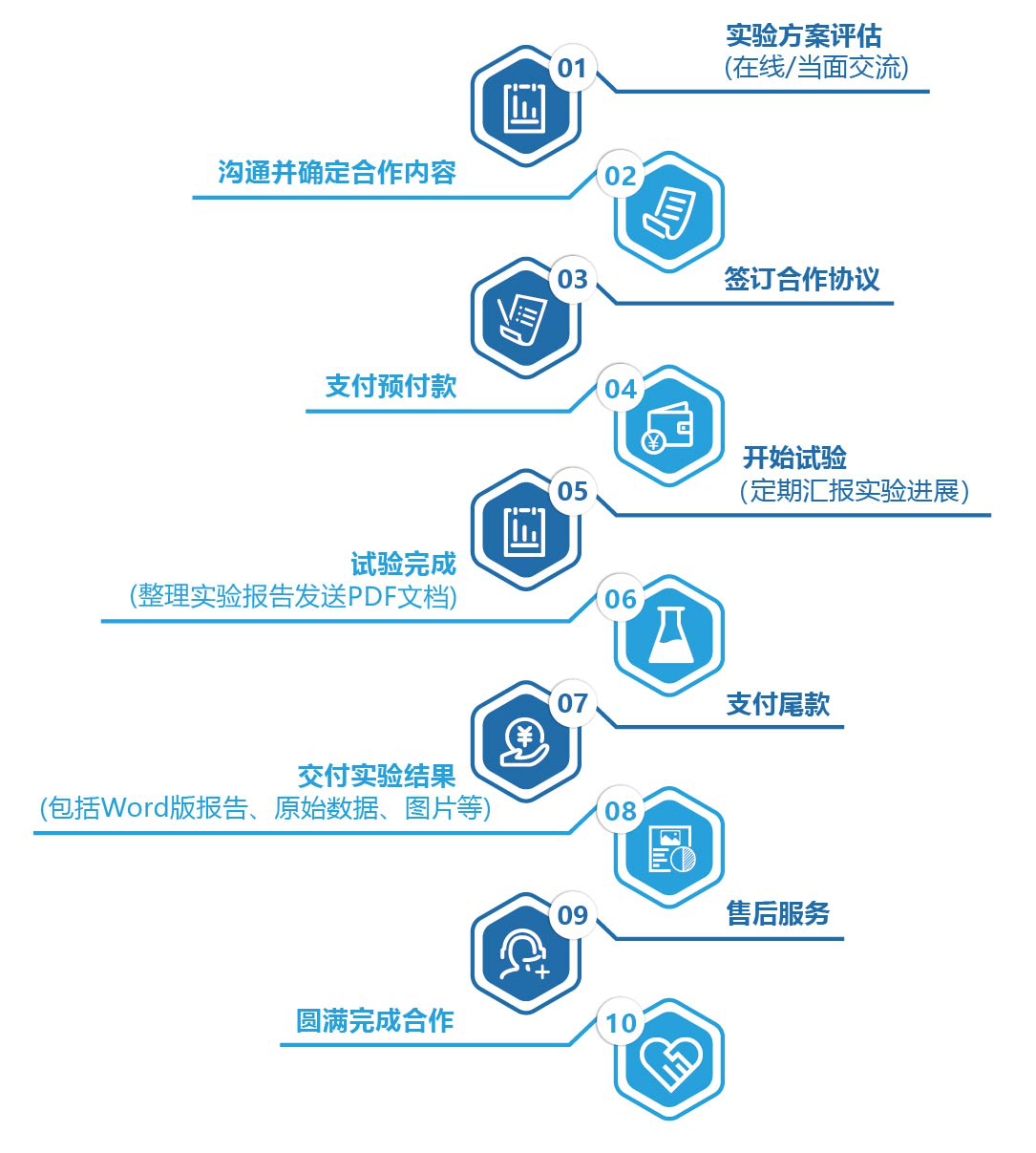
七、服务流程
病理学检测
分子生物学检测
免疫学检测服务
细胞实验服务
动物实验平台