
一、实验原理
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。此时固相上的酶量与标本中受检物质的量呈一定的比例。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
目前使用的酶联免疫检测方法很多,其种类按检测目的可分为:
间接法——用于测定抗体
双抗体夹心法——主要用于测定大分子抗原
竞争抑制法——主要用于测定小分子抗原
双抗体夹心法(测抗原)
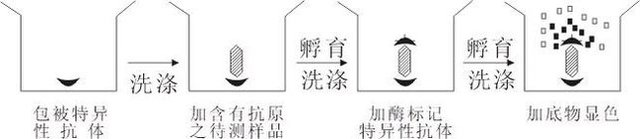
本法首先也是用特异性抗体包被于固相载体,经洗涤后加入含有抗原之待测样品,如待检样品中有相应抗原存在,即可与包被于固相载体上的特异性抗体结合,经保温孵育洗涤后,即可加入酶标记特异性抗体,再经孵育洗涤后,加底物显色进行测定,底物降解的量即为欲测抗原的量。
这种方法欲测的抗原必须有两个可以与抗体结合的部位,因为其一端要包被于固相载体上的抗体作用,而另一端则要与酶标记特异性抗体作用。因此,不能用于分子量小于5000的半抗原之类的抗原测定。我们用在霍乱肠毒素的测定。HbSAg及HbS的测定。
间接法测抗体
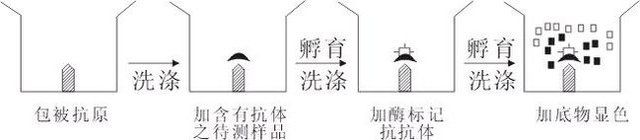
间接法首先用抗原包被于固相载体,这些包被的抗原必须是可溶性的,或者至少是极微小的颗粒,经洗涤,加入含有被测抗体之标本,再经孵育洗涤后,加入酶标记抗抗体,(对人的标本来说即加酶标抗人球蛋白IgG、IgM),再经孵育洗涤后,加底物显色,底物降解的量,即为欲测抗体的量,其结果可用目测或用分光光度计定量测定,本法用同种抗原包被固相载体后,只要用一种酶标记抗人球蛋白,即可作多种人的传染病、寄生虫病以及其他疾病的血清学诊断。如用酶标记抗人IgM,则可用于早期诊断。
竞争法测抗原

本法首先将特异性抗体吸附于固相载体表面,我们把抗原和抗体吸附到固相载体表面的这个过程,称为包被(Coated),也可叫做致敏。经洗涤后分成两组:一组加酶标记抗原和被测抗原的混合液,而另一组只加酶标记抗原,再经孵育洗涤后加底物显色,这两组底物降解量之差,即为我们所要测定的未知抗原的量。
这种方法所测定的抗原只要有一个结合部位即可,因此,对小分子抗原如激素和药物之类的测定常用此法。该法的优点是快,因为只有一个保温洗涤过程。但需用较多量的酶标记抗原为其缺点。
二、应用简介
酶联免疫吸附(ELISA)可以:(1)免疫酶染色各种细胞内成份的定位。(2)研究抗酶抗体的合成。(3)显现微量的免疫沉淀反应。(4)定量检测体液中抗原或抗体成份。
三、实验方法
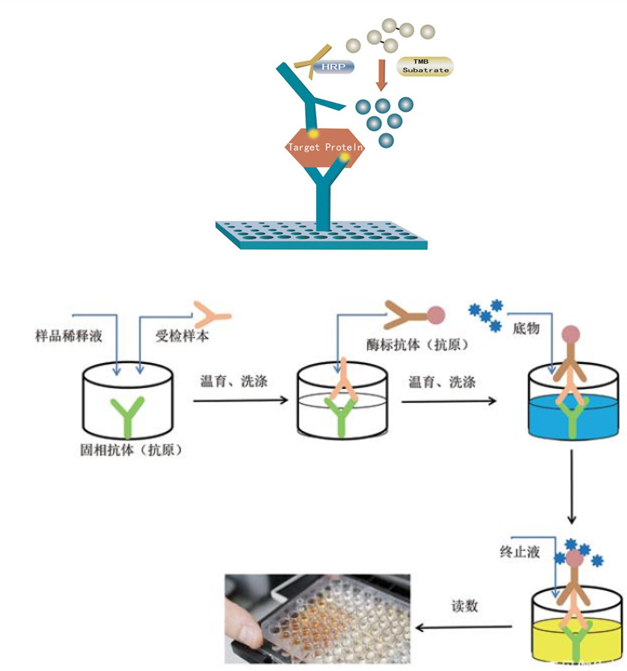
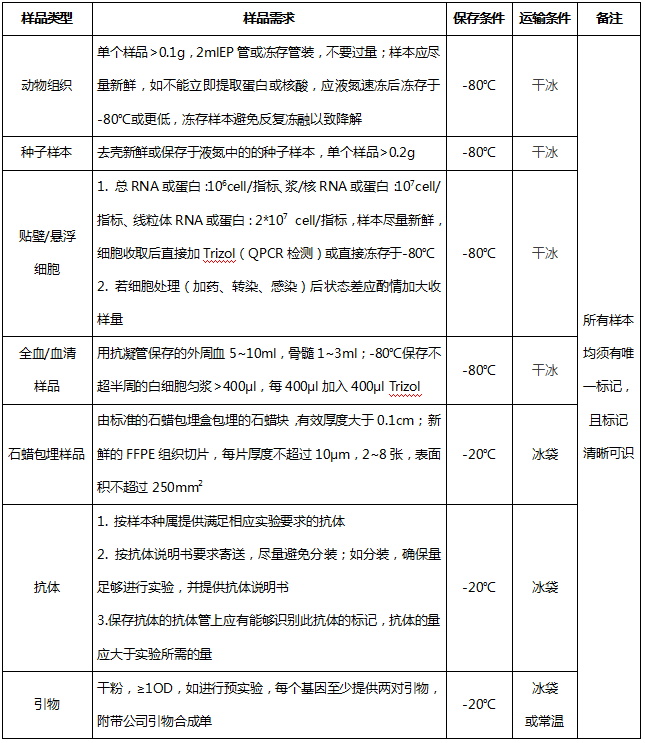
四、 样本送检要求
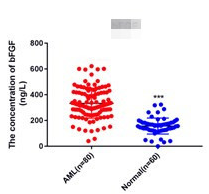
五、案例展示

六、常见问题
1) 双抗体夹心法(测抗原)
1.可溶性抗原或抗体吸附于固相载体而成为不溶形式,这是进行酶标记测定的基本条件。许多物质可作为固相载体,如纤维素、交联右旋糖苷、琼脂糖珠、聚丙烯、聚苯乙烯、聚乙烯及聚氯乙烯等等。但在ELISA中最常用的是聚苯乙烯或聚氯乙烯微量反应板及塑料管。
2.包被所用的抗原必须是可溶性的,而且要求是优质和稳定的制剂,纯度和免疫原性要高。如果不纯,由于抗原中所含杂质就会竞争固相载体上的有限位置,降低敏感性和特异性。此外还应考虑到制备包被抗原不应破坏其免疫学活性。
3.对某些抗原必须进行提纯,如病毒的组织培养和鸡胚培养物以及病毒接种动物的脏器等,它们当中存在着许多非抗原的蛋白质,必须设法除去,常用梯度超速离心或亲和层析法提纯,不经提纯是不能使用的。
4.用最适稀释度抗原,包被固相载体不仅经济,而且可以克服前带现象。可通过棋盘滴定法进行测定,但用单项滴定法更为简便,其方法是将抗原进行一系列稀释包被微量反应板,再用一定稀释度的阳性参考血清和阴性参考血清进行孵育后洗涤,再加酶结合物进行反应,经孵育洗涤后,加底物溶液显色,终止反应后分别测定OD值,选择OD值≥1.0的那个抗原稀释度为最适包被浓度。一般总是要选择那个OD值稍大于1.0,而不选择小于1.0的抗原浓度。阴性参考血清OD值要求<0.1-0.2。也就是要求阳性参考血清和阴性参考血清的OD值有明显差别。
5.抗原包被固相载体除浓度外,对时间、温度、PH均有关系。温度高(如37℃、45℃、或56℃),包被时间可缩短,温度低可延长包被时间。但为了方便起见,通常采用4℃包被过夜,可使抗原吸附得更加完全且均匀。在用聚苯乙烯或聚乙烯微量反应板或塑料管作固相载体时,在碱性条件下(如0.1 mol/L、PH9.6碳酸盐缓冲液稀释抗原)4℃包被过夜较为合适。但在某些试验中,如用LPS或毒素蛋白包被时,用PH 7.2-7.4 PBS稀释才是满意的。包被特异蛋白质的浓度为1-10 ug/ml,而对某些病原微生物抗原以5-20 ug/ml较为合适,但均应通过滴定。
2) 间接法(测抗体)
1.应注意分离血清时,血液要求放置室温中凝固收缩,不宜置冰箱(4℃)中凝固,否则会使大部分IgM和少量IgG丧失活性。
2.为了使特异性结合的抗体量尽可能多,包被微量反应板凹孔的抗原应该稍微过量。
3.在孵育或洗涤过程中,已吸附的抗原可能有部份会从固相载体上被洗涤下来。从而使加入被检血清中的特异性抗体以外的蛋白质很可能会吸附到原来包被抗原凹孔的空白处,增加本底颜色,产生假阳性反应。
4.在稀释剂及洗涤剂中加入各种保护性阻剂可用来抑制非特异性蛋白的竞争性吸附作用。
5.在稀释剂和洗涤剂中所加的吐温-20很重要。它不仅能消除非特异性的本底反应,而且还可增加阳性标本的敏感度,这可能与吐温-20能分离所吸附的非特异性物质有关。目前采用的洗涤剂为PH7.4 PBS(含0.2‰KCL)加0.05%吐温-20,如无吐温-20,也可用吐温故-40或吐温-60代替。但吐温-80本底较高,不宜应用。
3) 竞争法测抗原
1.试验的重复性(精确度)
有二种方法来检验试验的精确度:通常用变异系数来表示:1、几个样品用ELISA法同时进行多次测定求出CV%;2、不同时间对不同操作者对某几个样进行多次测定求出变异系数。CV是个体参数标准差与平均数的比率。
S / X=CV,CV应低10%,不应大于10~15%。
不论目测或分光光度计测定,均可作一个稀释度或一系列稀释度测定,一般常规诊断只用一个稀释度判断阳性或阴性就可以了,这样比较方便,现在推荐传染病的血清诊断用1:200一个稀释度。有些需要精确定量的,可作一系列稀释度测定。
记录结果有下列几种方法:
1.“+”或“-”:所有超过规定的OD值(如OD,0.4)的标本均属阳性,此规定OD值是根据事先测定大量阴性标本所取得的,此规定值是阴性标本的上限。或者以一组阴性标本OD平均值加2~3个标准差作为阳性阈值。
2.直接以OD值来表示,如0.4、0.7、1.2,OD值越大,阳性反应越强,但此数值是在固定实验条件下得到的结果,而且每次实验都要有参考标本作对照。
3.以终点滴度表示:将标本作连续稀释,最高稀释度能出现阳性反应者(即OD值仍大于阳性阈值,即为该标本的滴度。
4.以“比值表示:求出被检标本的OD值与一组阴性标本OD值的比值,例如为阴性标本的2倍或3倍,即为阳性,比值小于2.1而大于1.5为可疑,<1.5为阴性。
测定标本OD值-空白OD值
阴性对照OD值-空白OD值
如在此测定时以空白校正“O”点。
5.以“单位”来表示:在测定被检标本的同时,再测定一个含已知单位数的阳性参考血清,用不同稀释度作ELISA检测后,以OD值为纵坐标,单位数为横坐标,画出标准曲线。以后可根据被检标本的OD值,从曲线上找出相应的单位数,再乘于血清的稀释倍数,即可得出被检标本的单位数。
作试验时的阴性参考血清最好不要显色,否则会对结果判断带来困难,特别在目测时,当阳性标本OD值>2.0时,应作适当稀释后再作测定。
6.对使用仪器要求
所用仪器如吸管、烧杯试管都要清洁,用于酶结合和底物的吸管和容器一定要分开。试剂要求标准化。
七、服务流程
病理学检测
分子生物学检测
免疫学检测服务
细胞实验服务
动物实验平台