吉利德科学公司近日宣布,美国FDA解除了对在研药物 magrolimab 联合阿扎胞苷治疗骨髓增生异常综合征 (MDS) 和急性髓细胞白血病 (AML) 的临床研究的搁置。吉利德科学公司正在与监管机构密切合作,计划重新开放在美国境外暂停的有关 magrolimab 的研究。
骨髓增生异常综合征 (MDS) 是一种罕见的、通常未被识别、诊断不足的骨髓疾病,被广泛认为是一种癌症。在 MDS 中,人体的骨髓不能产生足够的成熟、健康的红细胞、白细胞和/或血小板。虽然许多病例可能未被确诊,但目前的估计显示每年约有 100,000 例新病例被诊断出来。在过去的 15 年中,高危 MDS 的治疗进展有限,干细胞移植是唯一的潜在治愈方法,但 65 岁以上或患有其他疾病的患者通常不符合干细胞移植条件。三分之一的 MDS 患者会发展为急性髓细胞白血病 (AML) ,这是成人中最常见的白血病类型之一。在美国,每年约有 10,000 人死于 AML。
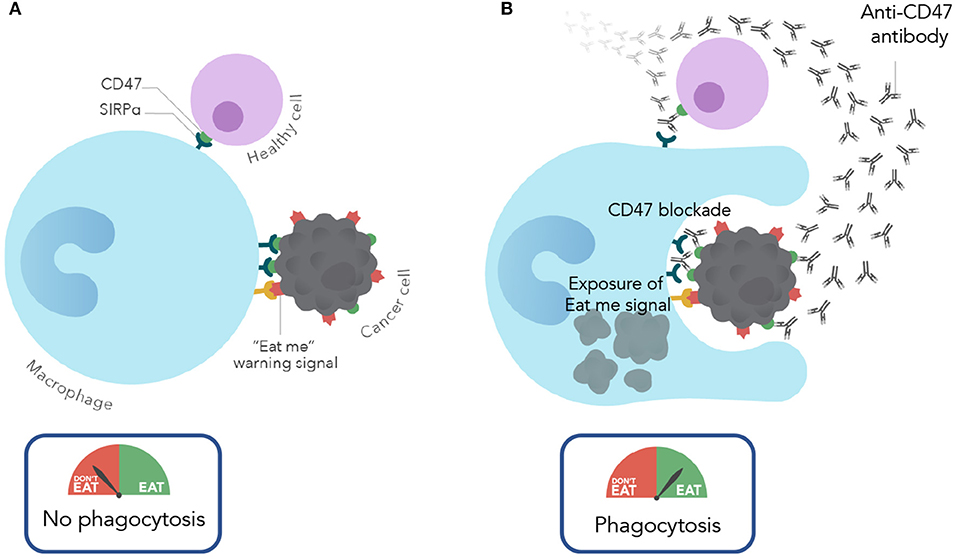
Magrolimab 是一种靶向 CD47 的研究性单克隆抗体,旨在干扰巨噬细胞上的 SIRPα 受体对 CD47 的识别,目的是阻断“不要吃我”信号被癌细胞用来避免被巨噬细胞摄取。Magrolimab 正在开发用于治疗多种血液系统癌症,包括骨髓增生异常综合征 (MDS)、急性髓性白血病 (AML) 以及实体瘤恶性肿瘤。
在部分临床暂停期间,已经参加受影响的吉利德 magrolimab 研究(包括关键的 3 期 ENHANCE 研究)的患者将继续接受治疗。在试验重新启动之前,吉利德已经达到了 ENHANCE 研究第一次中期分析所需的预先指定的入组门槛。基于此,吉利德有信心在 2023 年按计划进行第一次中期分析。
Magrolimab 于 2020 年被 FDA 授予治疗新诊断 MDS 的突破性疗法认定。除了 MDS 和 AML 外,magrolimab 正在被开发用于几种血液系统癌症和实体瘤恶性肿瘤。

业务咨询

投诉建议

医思倍视频号