
今年2月,中国国家癌症中心最新统计数据显示:我国每年有高达81.6万人被确诊为肺癌(占所有癌症17.9%),因肺癌死亡的有71.5万人(占所有癌症23.8%),均居所有癌症首位[1]。
近几十年来,靶向治疗改写了非小细胞肺癌(NSCLC)的治疗范式,随着NGS检测技术的不断革新,一些新的罕见突变越来越多被诊断出来。EGFR 20号外显子插入突变(EGFR exon20ins)就是其中一个。
虽然EGFR exon20ins仅占全部NSCLC的2%,但由于发病人群基数大,每年仍有超过一万名新发肺癌患者携带这个突变,尤其在女性、非吸烟者和亚洲人中更为高发[2]。
治疗肺癌的精准靶向利器EGFR-TKIs(如吉非替尼、阿法替尼、奥希替尼等)对EGFR敏感突变阳性NSCLC患者效果显著,但对EGFR exon20ins毫无办法。究其背后原因,以上药物分子很难有效结合到20号外显子编码的结构域上,所以临床效果甚至劣于培美曲塞+铂类化疗或化疗联合贝伐珠单抗[3]。
这就导致EGFR exon20ins患者预后和生存现状极为触目惊心,与EGFR敏感突变相比,死亡风险增加了75%,疾病进展或死亡风险增加93%,五年生存率仅有8%[4],中位生存期更是只有EGFR敏感突变类型的一半(16.5个月V.S. 33个月)。更加令人心寒的是,在其他肿瘤领域大杀四方的免疫治疗对EGFR exon20ins亦是一筹莫展,效果差强人意[5-7]。不难看出,此类患者亟需有效的治疗手段。
近日,由北京协和医院王孟昭,台湾大学医学院杨志新和哈佛大学医学院附属Dana-Farber癌症研究院Pasi A. Jänne领衔的研究团队,在著名期刊Cancer Discovery上发表重要研究成果[8]。
他们探索了口服、强效、不可逆和选择性的EGFR exon20ins酪氨酸激酶抑制剂——Sunvozertinib(DZD9008)的临床活性。从这个早期研究结果来看,总体人群客观缓解率(ORR)为41.1%[8]。这一研究成果给EGFR exon20ins突变患者带来新的希望。

论文首页截图
关注EGFR exon20ins的朋友肯定知道,美国FDA在2021年相继批准了Mobocertinib和Amivantamab用于治疗EGFR exon20ins的成人NSCLC患者。
不过临床数据显示:Amivantamab仅有40%的客观缓解率[9-10],而Mobocertinib这一数据则只有28%[11],并且在进行Mobocertinib治疗的患者中,有40%不可避免地产生3级及以上的副反应,21%产生了3级及以上的严重腹泻症状,导致不耐受而停药[12-13]。虽说Mobocertinib和Amivantamab给EGFR exon20ins治疗带了新的曙光,但不甚理想的疾病缓解率和高发的3级及以上副反应让EGFR exon20ins的临床治疗需求远远没有得到满足。
以奥希替尼为骨架研发的Sunvozertinib,有望给EGFR exon20ins带来新的希望。从Sunvozertinib的临床前实验室数据来看:在A431细胞系中,与野生型EFGR相比,Sunvozertinib对EGFR exon20ins的选择性是前者的1.4-9.6倍,特别insASV/insSVD/insNPH这三种亚型则表现出2.5-3.1倍的高度选择性[8]。
由于EGFR exon20ins突变型在发生构象改变后的蛋白结构与野生型EGFR相似,靶向药抑制突变蛋白的同时,也可能结合并抑制正常细胞中的野生型EGFR蛋白[14],高选择性可以在一定程度上避免剂量限制性毒性,降低副反应发生率。
另外,在EGFR exon20ins(ins ASV亚型)的转基因大鼠模型上,与空白对照相比,Sunvozertinib也展现出了更好的抗肿瘤效果(**P < 0.01)。即便实验室的数据再好,那也只是万里长征的第一步,“是驴子是马”终究要用临床数据来“遛遛”。
正是基于以上临床前研究数据,王孟昭等领衔的研究团队发起了早期临床研究。
在2019年7月9日-2021年4月3日研究期间,研究人员在全球25个中心(WU-KONG1研究在美国、澳大利亚、韩国和中国台湾的17个中心进行;WU-KONG2研究在中国内地的8个中心同步开展)共纳入了102名EGFR或HER2 20外显子插入突变的NSCLC患者,其中62名患者(60.8%)伴有EGFR exon20ins,既往都接受过2线及以上的治疗,包括之前已使用Amivantamab治疗以及基线脑转移的患者。
在试验人群中,每日服用一次Sunvozertinib,剂量递增列队的剂量范围为50-400mg,剂量扩展列队为200-400 mg,最佳耐受剂量为400mg。
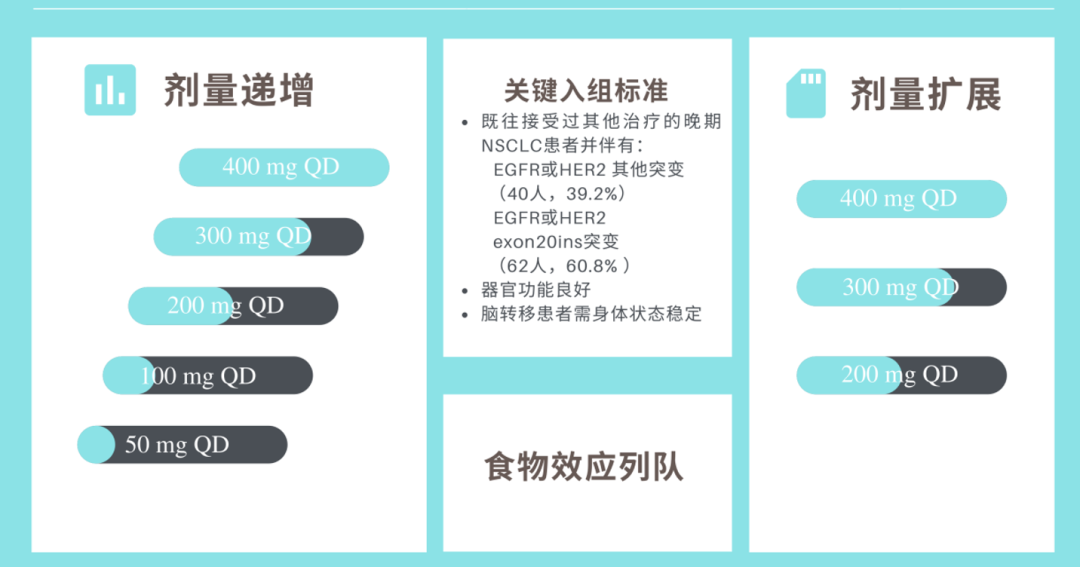
Sunvozertinib I/II期临床实验设计
在这两项正在开展的临床研究(WU-KONG1和WU-KONG2)中,有56名携带EGFR exon20ins的患者被纳入本次分析。
总的来看,Sunvozertinib治疗剂量≥100mg/次/日对具有不同亚型的患者均有效,总体人群客观缓解率(ORR)为41.1%,确定客观缓解率(C-ORR)为37.5%。特别在基线脑转移患者比例高达49%的300mg剂量组,ORR达48.4%,C-ORR为41.9%,疾病控制率(DCR)达90.3%,显著优于市面上的其他EGFR TKIs疗效[8]。
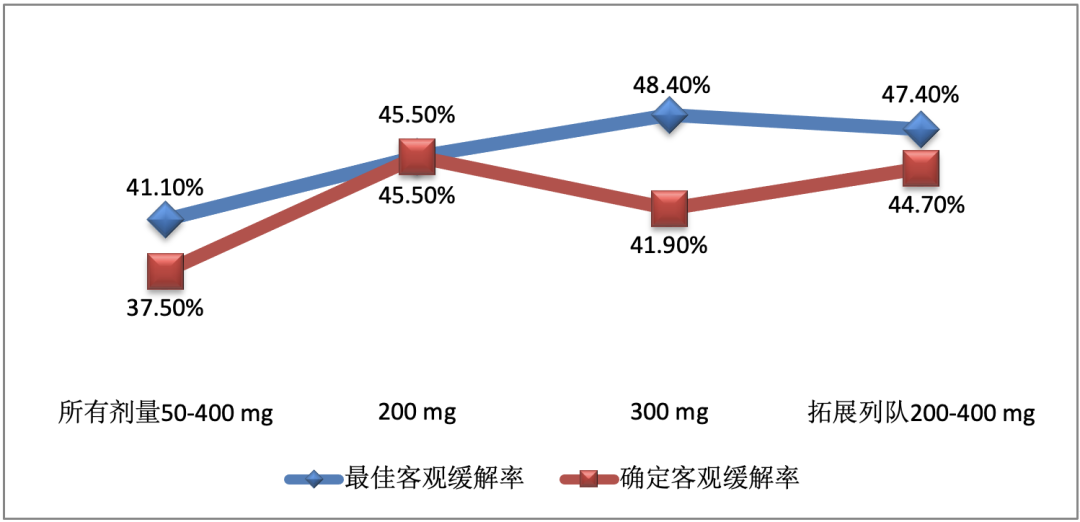
Sunvozertinib在56名不同剂量列队EGFR exon20ins患者中的缓解率
值得一提的是,在一些EGFR T790M和HER2 exon20ins双突变的患者中,Sunvozertinib也展现了初步的抗肿瘤效果,值得今后更大样本深入研究。
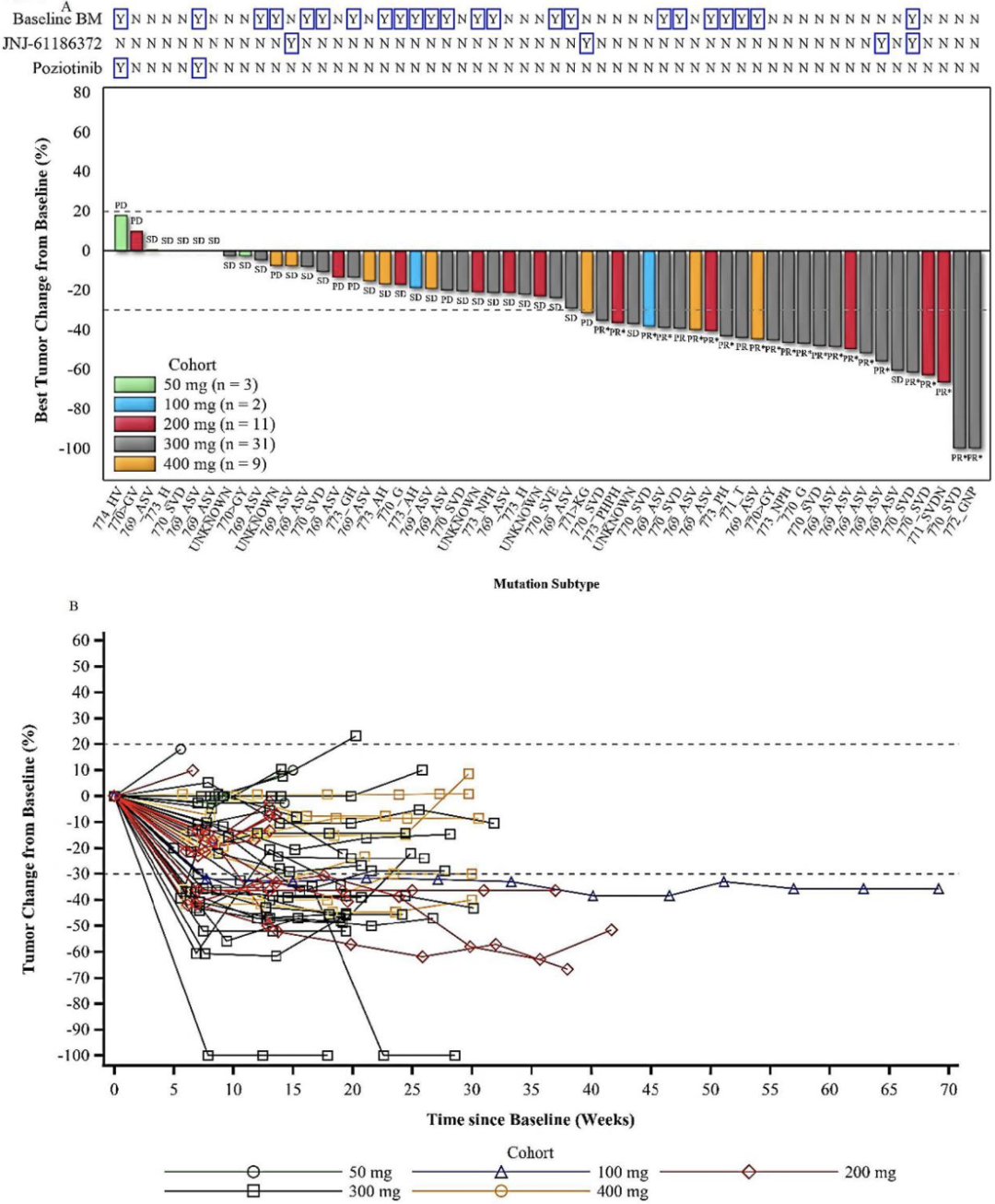
Sunvozertinib在56名EGFR exon20ins患者中的临床效果
从安全性来看,患者的整体耐受性良好,不良反应可控。其中常见不良反应是腹泻和皮疹,其中3级及以上不良反应为腹泻(4.9%),没有发生3级及以上的皮疹反应。与阿法替尼、达可替尼和Mobocertinib相比,Sunvozertinib展现出更低的因药物相关不良事件导致永久停药、减剂量及≥3级副反应发生率[15-16]
在药代动力学方面,血药浓度与剂量成呈正向依赖,且在人体中半衰期长达约50小时,每日给药一次即可保持血药浓度稳定,在≥100 mg的日剂量下,Sunvozertinib的谷底浓度能持续覆盖pEGFR IC50,对患者友好,能够提升临床依存性。PK曲线平缓,药物峰值和谷底浓度相差较小,有利于降低因药物峰值浓度波动过高所引起的不良反应发生率。另外食物效应试验结果表明:是否随餐对药物代谢没有临床意义上的影响。
基于以上数据,我们不难发现,Sunvozertinib具有良好的安全性、耐受性、PK/PD相关性和初步疗效,有潜力成为一个更有效的全新靶向口服药物,这为其进一步临床开发提供了依据。
不过,这个研究也存在一些局限性,例如:在基线脑转移患者中观察到的抗肿瘤活性,评估时并没有将颅内病变作为目标参数,而且治疗脑转移的效果可能与相同剂量的奥希替尼无显著性差异,未来的研究将有必要来证实这一发现。另外,Sunvozertinib如果能在后续公布的PFS和OS两个黄金指标数据上显著优于Amivantamab和Mobocertinib,那么顺利上市并尽早造福患者才真的算是指日可待。